서 론
식물은 의약품, 향료, 색소, 식품 첨가제 등의 산업에 널리 사용되는 2차 대사산물의 저장소이다. 식물은 1차 또는 2차 대사산물로 분류될 수 있는 다양한 유기 화합물을 생산하며, 2차 대사산물은 식물의 생명 유지에 필수적인 물질은 아니지만, 식물을 보호하고 환경에 적응시키는 데에 중요한 역할을 한다. 모든 식물에 존재하며 생명에 필수적인 1차 대사산물(예: 피토스테롤, 아실 지질, 뉴클레오타이드, 아미노산 및 유기산)과 달리 2차 대사산물은 일반적으로 식물계 내의 제한된 수의 분류군에서 발생한다[1]. 이러한 화합물은 식물체에서 소량으로 생산되며, 주로 식물의 생리학적 발달 단계에 따라 달라진다. 본 리뷰에서는 식물 조직배양을 통한 캘러스, 부정근과 같은 세포자원 배양에서 유도물질을 처리하여 더욱 효율적으로 2차 대사산물을 생산하는 내용을 중점으로 소개하고자 한다.
식물에서 세포자원을 유도하고 배양하기 위해서는 영양분이 들어간 배지 조성과 식물 성장 호르몬이 필수적이다. 일반적으로 사용되는 식물 성장 호르몬은 생장조절제인 cytokinin류와 auxin류이다. Cytokinin의 대표적인 예로는 kinetin, 6-benzylaminopurine 등이 있고, auxin의 대표적인 예로는 indole-3-acetic acid, 2,4-dichlorophenoxyacetic acid(2,4-D) 등이 있다. Auxin의 함량이 더 높은 경우에는 뿌리가, cytokinin의 함량이 더 높은 경우에는 새싹이 유도되기 때문에 auxin과 cytokinin의 적절한 비율과 조성을 영양배지에 첨가하여 캘러스를 유도하는 과정이 중요하다[2].
외부 스트레스로 인한 식물의 방어 반응에 따라 생성되는 물질을 파이토알렉신(phytoalexin)이라고 한다[2]. 이러한 화합물은 2차 대사산물로서 항생물질과 같은 역할을 하며, 인체에 생리 활성 물질로 작용하는데, 이들 물질의 생성을 유도하는 화합물 혹은 자극들을 유도물질(활성유도제, elicitor)이라고 한다[2]. 유도물질은 기원에 따라 내인성(endogenous) 및 외인성(exogenous)으로 분류되며, 특성에 따라 비생물학적(abiotic)과 생물학적(biotic) 유도물질로 분류될 수 있다. 비생물학적 유도물질이란 주로 염이나 물리적 요인과 같은 무기 화합물 기원의 물질이고, 생물학적 유도물질이란 키틴(chitin), 펙틴(pectin), 셀룰로스(cellulose)와 같은 식물 세포벽과 미생물에서 유래한 다당류를 포함하는 생물학적 기원의 물질이다. 유도물질은 생합성, 축적, 액포 저장, 전환, 분해 속도를 변형하여 2차 대사물질의 합성에 영향을 미친다. 생물학적 유도물질과 비생물학적 유도물질을 혼합한 유도과정은 단일 유도제보다 2차 대사산물 생산을 촉진하는 데에 더 큰 상승적 효과를 나타낼 수 있다. 이 과정에서 유도물질의 종류, 농도, 처리 시기 및 배지와 유도물질과의 적합한 혼합처리도 2차 대사산물의 증대에 영향을 미치는 주요 조절 요인이다[3].
고령화 사회 진입으로 인해 항노화에 대한 소비자들의 수요와 항노화 소재 시장은 더욱 커지고 있다. 국내외적으로 친환경 바이오산업을 통한 천연 소재 발굴 및 개발이 대두되고 있고, 국내에서는 친환경 바이오 소재 개발이 국가적 전략사업의 하나로 특화되고 있다. 특히, 앞서 언급한 식물 조직배양을 비롯한 다양한 생명공학 기술을 이용하여 바이오 소재를 개발하는 산업화가 다양하게 이루어지고 있다.
이 리뷰는 식물 조직배양을 통해 생리활성을 가진 2차 대사산물의 생산을 효율적으로 증진하기 위한 다양한 생물학적 유도물질 처리 기술과 이를 통한 산업화 가능성을 중심으로 요약한다.
본 론
전통적인 농업 기술을 활용하여 식물을 키우는 데는 오랜 시간이 걸리며, 식물의 생육은 전체 생육 주기 동안 기후, 환경, 병해충, 미생물에 의해 여러 영향을 받기 때문에 한계가 있다[4]. 그래서 생장 주기가 짧고 환경이나 지리적으로 제한이 없으며, 배양 환경을 인위적으로 조절이 가능한 식물 조직배양 기술을 활용한 연구가 활발히 진행되고 있다.
식물 조직배양은 식물 세포가 전형성능(totipotency)을 가지고 있다는 특성을 활용한 배양 방법이다. 이 기술은 식물의 기관, 조직 또는 세포 등을 식물체에서 분리해서 영양분이 공급된 무균 상태의 기내에서 배양하여 캘러스나 단세포집단을 유기시키거나, 식물체나 기관을 캘러스, 세포 등에서 식물체로 재분화시키는 일을 말한다. 이는 생중량(biomass)의 확보가 어렵거나 배양 중에 유전적 변이나 표현형적 변이와 같은 돌연변이가 발생하여 초기 재료의 형질을 잃어버릴 수도 있다. 또한 계대 배양을 진행할수록 분화 능력이 소실될 수 있다는 단점도 가지고 있지만, 재배 공간의 효율적인 이용, 우수한 형질을 지니는 품종의 대량 생산, 그리고 식물체의 모든 부분을 이용 가능하다는 장점 때문에 다양하게 활용되고 있다.
식물 화학물질을 구분하는 경계는 명확하지 않지만, 기본적으로 지방산, 당, 아미노산 및 핵산과 같은 1차 대사산물과 2차 대사산물로 구분할 수 있다. 식물은 다양한 2차 대사산물을 함유하고 있는데, 일반적으로 이 물질은 자연에서 고등 식물이 다양한 스트레스에 노출될 때 일련의 반응을 거쳐 합성되는 방어 분자라고 할 수 있다. 2차 대사산물의 대표적인 예로는 테르페노이드(terpenoid), 알칼로이드(alkaloid), 페닐프로파노이드(phenylpropanoid) 등이 있다. 테르페노이드는 가장 큰 종류의 천연 화합물로서 다양한 생리학적 및 생태학적 기능을 가지고 있어 스트레스 조건으로부터 식물을 보호하고 향료, 화장품, 향수, 식품 첨가물, 바이오연료 등의 중요한 공급원 역할을 한다. 알칼로이드는 페닐알라닌, 오르니틴, 아르기닌, 티로신 및 트립토판과 같은 아미노산에서 직접 또는 간접적으로 파생된다. 이 물질은 항종양, 진통제 및 항염증 활성과 같은 약리학적 활성을 제공하거나 각성제로서 사용할 수 있다. 페닐프로파노이드는 티로신(tyrosine)과 트립토판(tryptophan)을 발생시키는 shikimate 경로의 핵심 산물인 페닐알라닌에서 파생되며, 생물학적 및 비생물학적 스트레스에 대한 식물의 방어 및 생존에 관여한다[1].
식물에 있어 ‘스트레스’라는 용어는 식물 기능, 성장 또는 번식을 변형하는 모든 요인(비생물학적 및 생물학적)으로 정의될 수 있다[5]. 유도물질이 유발하는 스트레스에 대한 식물의 반응은 일반적으로 세포 원형질막에서 시작된다. 이 리뷰에서는 세포배양에서 가장 많이 연구된 원형질막 관련 유도물질에 대해서 간단히 언급한다. 식물은 유도물질의 인식에 대한 공통적인 수용체를 가지고 있는 것으로 보인다. 유도물질이 유도하는 방어 반응에서 순차적으로 발생하는 사건은 다음과 같이 요약할 수 있다: 수용체에 의한 유도물질 인식, 원형질막 단백질 및 세포질 단백질의 가역적 인산화 및 탈인산화, 세포액(Ca2+) 증가, Cl− 및 K+ 유출과 H+ 유입, 세포외 알칼리화 및 세포질 산성화, 미토겐(mitogen) 활성화 단백질 인산화 효소(MAP kinase) 활성화, 니코틴아마이드 아데닌 다이뉴클레오타이드 인산(NADPH) 산화효소 활성화, 반응성 산소종 및 반응성 질소종(reactive oxygen species[ROS] 및 reactive nitrogen species[RNS]) 생성, 초기 방어 유전자 발현; 자스모네이트(jasmonate) 생산, 후기 방어 반응 유전자 발현 및 2차 대사산물 축적(Fig. 1). 공격을 예방하기 위해 식물이 이용하는 반응은 파이토알렉신 및 pathogenesis-related(PR) 단백질과 같은 항균 화합물의 생산으로 이어지며, 이는 병원균 거부에 중요한 역할을 한다. 또한, 유도물질을 인식하는 것은 미래의 병원체 공격에 대한 식물 저항성 수준을 증가시킬 수 있다. 유도물질 신호 변환은 다양한 순차적 반응에 의해 효율적인 방어를 설정하는 다양한 구성 요소로 이루어져 있는데, 이러한 구성 요소들은 서로 다른 표적 반응을 유도하는 병렬 또는 교차 연결 신호 경로로 구성된다[6].
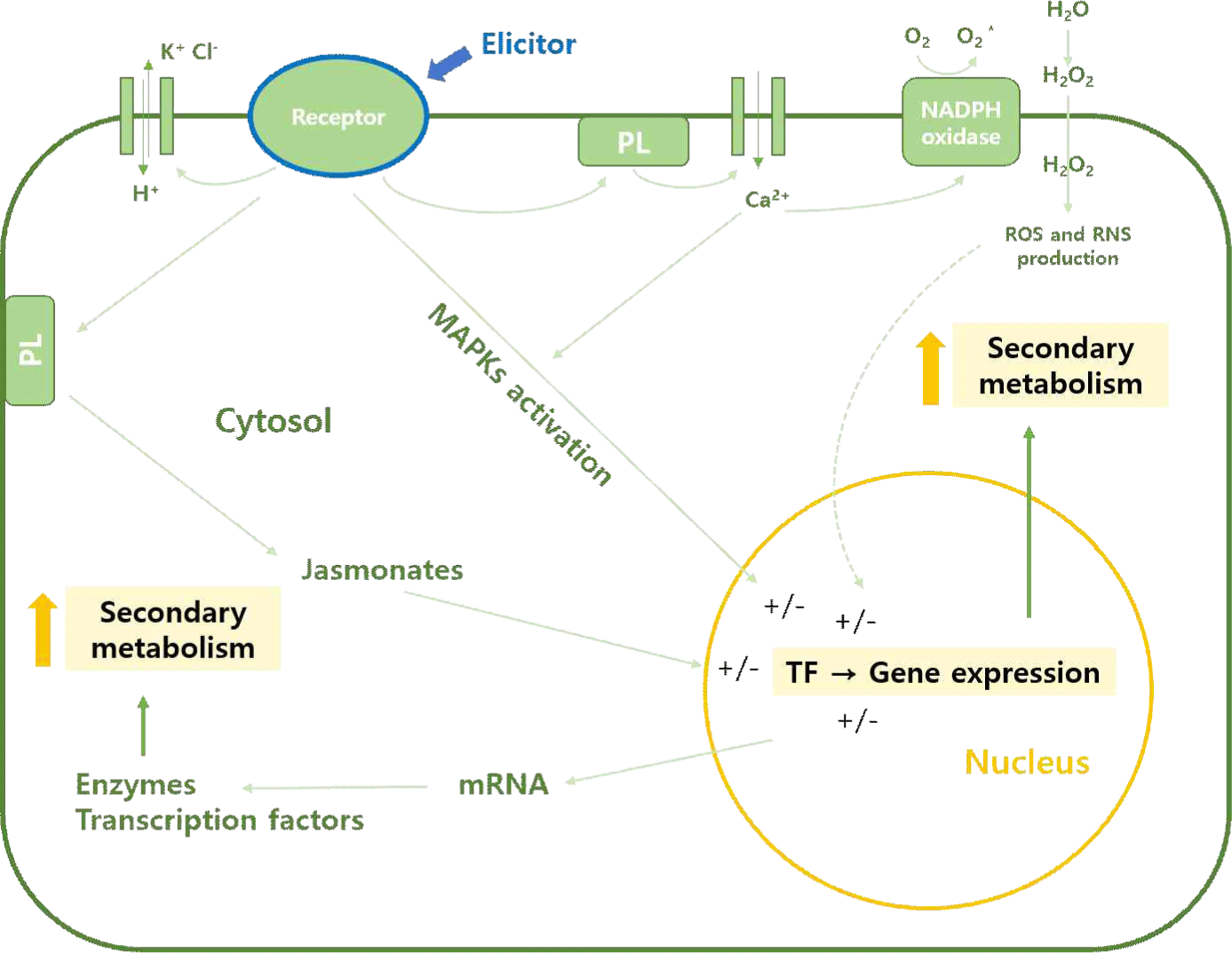
유도물질은 파이토알렉신의 생산을 유도할 수 있는 분자에 사용되었지만, 현재는 일반적으로 모든 유형의 식물 방어를 자극하는 화합물을 의미한다[6]. 유도물질은 그들의 기원에 따라 내인성 및 외인성 유도물질로 분류할 수 있고, 그들의 특성에 따라 비생물적(abiotic) 및 생물적(biotic) 유도물질로 분류할 수 있다. 식물 세포 외부에서 발생하는 물질은 외인성 유도물질, 식물 세포에서 유래된 물질은 내인성 유도물질이라고 한다. 비생물적 유도물질은 물리적 및 화학적 요인을 포함한다. 대표적인 물리적 요인으로는 자외선, 온도, 염분, 가뭄 등이 있으며, 화학적 요인에는 중금속이나 무기 화합물 등과 salicylic acid(SA), methyl jasmonate(MeJA) 및 jamonic acid(JA)와 같은 호르몬 유도물질이 속한다. 생물적 유도물질은 식물, 진균, 박테리아 등에서 유래된 유도물질을 포함한다. 이 리뷰 논문은 상업적으로 활용도가 높은 호르몬 유도물질과 생물적 유도물질을 중심으로 설명한다(Table 1).
| Elicitors | Culture system | Plant species | Secondary metabolites (SM) | Reference |
|---|---|---|---|---|
| MeJA | HR | Hyoscyamos niger | Scopolamine and hyoscyamine | [17] |
| CS | Vitis vinifera | trans-Resveratrol and stilbenes | [18] | |
| HR | Catharanthus roseus | Catharanthine | [19] | |
| CS | Artemisia annua | Artemisinin | [20] | |
| CS | Lavandula vera | Rosmarinic acid | [21] | |
| CS | Thevetia peruviana | Peruvioside | [22] | |
| MeJA, JA | CS | Mentha x piperita | Rosmarinic acid | [8] |
| JA | CS | Vitis vinifera | Resveratrol | [23] |
| CS | Calendula officinalis | Oleanolic acid | [9] | |
| SA | CS | Corylus avellana | Paclitaxel | [24] |
| CS | Linum album | Podophyllotoxin | [25] | |
| CS, HR | Hypericum spp. | Cadensin G; Paxanthone | [26] | |
| AR | Withania somnifera | Withanolide a, b; withaferin a and whitanone | [27] | |
| CS | Stephania venosa | Dicentrine | [28] | |
| Yeast extract and fungal elicitors | HR | Fagopyrum tataricum | Rutin; quercetin | [14] |
| CS | Silybum marianum | Silymarin | [29] | |
| CS | Gymnema sylvestre | Gymnemic acid | [30] | |
| HR | Ocimum basilicum | Rosmarinic acid | [31] | |
| Chitosan and chitin | CS | Corylus avellana | Taxanes | [32] |
| CS | Cistanche deserticola | Phenylethanoid glycoside | [16] | |
| CS | Vitis vinifera | Stilbenes; trans-resveratrol | [33] | |
| AR | Morinda citriflora | Total anthraquinones, phenolics and flavonoids | [34] | |
| HR | Artemisia annua | Artemisinin | [35] | |
| Cyclodextrin | CS, HR | Taxus globosa | Taxanes | [36] |
| Catharanthus roseus | Vindoline, catharanthine and ajmalicine | [37] | ||
| Taxus media | Taxanes | [38] | ||
| Catharanthus roseus | Ajmalicine | [39] | ||
| Vitis vinifera | Trans-resveratrol | [18] |
JA와 MeJA를 포함한 자스모네이트는 광범위한 식물 반응을 조절하는 cyclopentanone 계열의 화합물이며, in vitro 배양에서 2차 대사산물을 강화하는 효과적인 유도물질로서의 역할을 한다. 자스모네이트는 몇 가지 중요한 생리학적 및 발달 과정을 활성화하는 식물 특유의 신호 분자인데, 병원균의 공격과 상처에 의해 유도되는 호르몬의 생합성은 국소적으로나 전신적으로 방어 반응을 유발한다[6]. MeJA는 식물의 방어 유전자를 조절하는 신호 전달 과정에서 중요한 역할을 하는 것으로 알려져 있고, JA는 곤충에 대한 식물의 저항성을 제공하는 octadecanoid 경로를 통해 다양한 단백질의 생산을 유도한다. MeJA는 다양한 종의 식물 세포배양에 외인성 유도물질로 적용될 때, 일련의 2차 생합성 경로에 긍정적으로 영향을 미칠 수 있다[6]. 예를 들어, 애기장대(Arabidopsis thaliana)에 MeJA를 처리하여 안토시아닌 생산을 증대시켰으며[7], Mentha x piperita에 JA와 MeJA를 처리하여 로즈마린산 생산이 증진됐다는 연구 결과가 있다[8]. 또한, Calendula officinalis에 JA를 처리하여 올레아놀산 생산을 증대했다는 연구가 있다[9]. 이처럼 JA와 MeJA는 테르페노이드, 플라보노이드, 알칼로이드 및 페닐프로파노이드를 포함한 다양한 이차 대사 산물 생산을 증가시킬 수 있는 대표적인 유도물질이다[6].
SA는 박테리아, 진균 및 바이러스와 같은 병원체에 대한 저항성을 조절하는 방어 유전자 발현의 핵심 신호이다. 식물 방어 조절 시스템에서 중요한 역할을 하는 작은 분자이며, 많은 병원체에 대한 전신 획득 저항을 유도하는 것으로 알려져 있다. SA는 식물과 병원체의 상호작용이 일어날 때 감염 부위에 SA의 빠른 축적과 과민 반응을 유발하여 식물의 다른 부분으로 퍼져 2차 대사산물 생산을 유도함으로써 광범위한 방어 반응을 일으킨다. 이러한 반응으로 인해 SA가 2차 대사 유도물질로서 광범위하게 적용될 수 있다[6]. Taxus속에 관한 수많은 연구에서 디테르펜 알칼로이드 생산을 증가시키기 위해 SA를 이용하였으며[10], Corylus aveliana 세포배양에서 살리실산을 처리함으로써 항암 화합물의 생산을 성공적으로 향상시켰다는 연구가 있다[11].
Yeast extract(YE)와 진균 유도물질은 주로 식물 세포 또는 모상근 배양에서 2차 대사산물 생산을 증가시키기 위한 유도물질로 널리 사용되고 있다. 효모 Aureobasidium pullulans의 추출물을 Vitis vinifera 캘러스에 처리한 결과, 스틸벤 파이토알렉신의 축적이 증가했다[12]. 또한, Panax ginseng의 세포 현탁액과 모상근 배양액에 유도물질로 YE를 처리하여 사포닌 및 기타 알려지지 않은 화합물의 함량을 증진시켰다는 연구 결과도 있다[13]. 그리고 효모 polysaccharides를 Fagopyrum tataricum에서 유래한 모상근에 처리했더니 플라보노이드 생성이 향상되었다[14]. 이처럼 YE 및 진균 유도물질은 작용 기전에 대한 연구가 부족함에도 불구하고 다양하게 사용되고 있다.
균류 또는 효모 추출물과 이들의 유도체로부터 정제된 성분인 chitosan 및 chitin도 유도물질로 사용되고 있다. chitin은 곰팡이와 효모를 포함한 수많은 살아있는 유기체에 의해 합성되는 β-(1-4)-N-아세틸-D-글루코사민 단위의 장쇄 다당류이며, 세포벽 구성 요소이다. Chitin의 가장 중요한 유도체인 chitosan은 알칼리성 조건에서 고체 chitin을 부분적으로 탈아세틸화(deacetylation)하거나 chitin deacetylase를 사용한 효소적 가수분해에 의해 얻어진다[6]. Chitosan과 chitin을 처리한 Taxus chinensis 세포 현탁액은 paclitaxel 생산을 증가시켰고[15], Cistanche deserticola 세포 현탁액 배양에 chitosan을 처리하여 페닐에타노이드 글리코사이드 축적의 최적 조건을 찾았다는 연구 결과도 있다[16].
마지막으로 α-1,4 글리코시드 결합으로 연결된 올리고당 계열의 cyclodextrin(CD)이 있다. 비공유 결합력을 통해 상호 작용하는 공간에서 CD는 저분자, 단백질 및 다양한 화합물과 포접 복합체를 형성할 수 있게 한다. 1981년 발견 이후 널리 연구된 가장 일반적인 CD에는 각각 6, 7 및 8개의 포도당 단위로 구성된 α-, β- 및 γ-CD가 포함된다. 낮은 분자 독성과 면역원성을 가지고 있어 제약 분야에서 긍정적으로 활용하고 있으며, 약물로 봉입체를 형성하는 데 사용되었다. 최근 몇 년 동안 CD는 식물 세포배양에서 방어 반응을 유도할 수 있어 진정한 유도물질로 작용할 수 있는 제제로서 상당한 관심을 끌었다[6]. V. vinifera에서 CD는 트랜스-레스베라트롤 생합성 경로와 관련된 유전자의 발현을 조절하는 다양한 전사 인자 계열을 활성화하는 신호 전달 과정(signal transduction cascade)을 유도하는 것으로 나타났다.
전 세계적인 고령화 시대로 이르면서 항노화 소재에 대한 소비자들의 인식과 항노화 관련 시장의 고성장이 전망되고 있다. 항노화 소재로서 최근 들어 식물 세포배양을 기반으로 코스메슈티컬, 건강기능식품, 의약품 등의 소재로 활용되는 식물 세포 유래 유효물질(식물세포자원, 성장인자, 펩타이드 등)과 식물 세포 유래 약리 물질(항체, 백신 등 바이오 의약품)의 연구 개발 및 제조가 다양하게 이루어지고 있다.
식물 유래 2차 대사산물의 활용 기술은 매우 발달하였으며, 신약 개발을 위한 식물 대사산물의 대량 분석기술과 대사체학(metabolomics)의 도입으로 인해 약용식물의 활용은 매우 정교하게 산업화가 이루어지고 있다. 이러한 첨단 생명공학 기술로 발굴한 소재는 항산화 정도, 세포 증식 효과, 암세포 독성 등 다양한 활성에 따라 중요한 산업용 기능성 물질로 사용되고 있다. 특히 탁월한 항산화 기능, 미백 기능, 세포 증식 효과 기능 등을 이용한 항노화 및 미백 기능성 화장품의 소재로서 다양한 제품이 개발되고 있다.
본 리뷰와 관련된 최근 국내·외 기술 개발 현황 및 트렌드를 살펴보면 다음과 같다. 최근 줄기세포 화장품의 트렌드 변화는 화학 화장품, 천연물 화장품, 기능성 화장품, 한방 화장품을 거쳐 생명공학 기술이 융합된 줄기세포 기술과 고기능 나노물질이 함유된 바이오 화장품의 트렌드로 변화하고 있다. 이로써 한국이 동물과 식물을 망라하고 줄기세포 화장품을 선도하는 경쟁우위를 차지하고 있는 화장품이 개발되고 있다. 이러한 국내 화장품 산업 추세에 맞춰 정부 정책 방향으로 식약처는 줄기세포 배양액 추출물이 함유된 화장품 제조 및 안정화 방법에 대한 세포·조직의 배양액을 원료로 함유하는 화장품의 기준 및 시험방법 발표하였다. 또한 글로벌 화장품 산업 수출 전략으로 신기술과 창조기술인 줄기세포 화장품의 트렌드를 적극 지원하고 있다.
최근 국내의 식물 세포 유래 유효물질을 통해 산업적 응용의 예로는 국내 ‘주식회사 바이오에프디엔씨(BIO-FD&C, Incheon, Korea)’에서 특화된 식물 세포배양 기술을 활용한 식물유래 재조합 성장인자, 피토펩타이드, 장미 세포자원을 포함한 다양한 형질전환 식물세포자원(유효물질)을 주력으로 생산하고 있으며, 꾸준한 매출 및 이익 성장을 시현하고 있다.
요 약
식물에는 의약품, 화장품, 향료, 재생 연료, 식품 등 다양한 분야에서 사용할 수 있는 가치 있는 2차 대사산물이 있다. 그러나 식물에서 2차 대사산물을 대량으로 생산하는 것은 환경적 요인으로 인해 한계가 있다. 외부 환경에 영향을 받지 않는 기내 식물 조직배양은 기존 재배 방법에 대한 효과적인 대안이 될 수 있다. 유도물질 처리는 비생물학적 및 생물학적 유도인자를 인위적으로 처리하여 스트레스 반응을 유도하는 기술이다. 유도물질 처리를 통한 2차 대사산물의 증진은 다양한 산업에 경제적 이익을 제공할 수 있다. 따라서 식물 세포배양 및 유도물질 처리는 생리활성이 있는 2차 대사산물의 생산을 증가시킬 수 있고, 산업적으로 활용될 수 있는 유용한 기술이다. 고령화 사회에서 노화 방지 및 친환경 소재가 주목을 받음으로써 식물 유래 생리활성 물질의 활용 가치가 높아지고 있다. 이 리뷰 논문의 주요 목적은 중요한 2차 대사산물 생산에 사용되는 식물 세포배양 및 유도물질 처리 기술을 요약하는 것이다.






