서 론
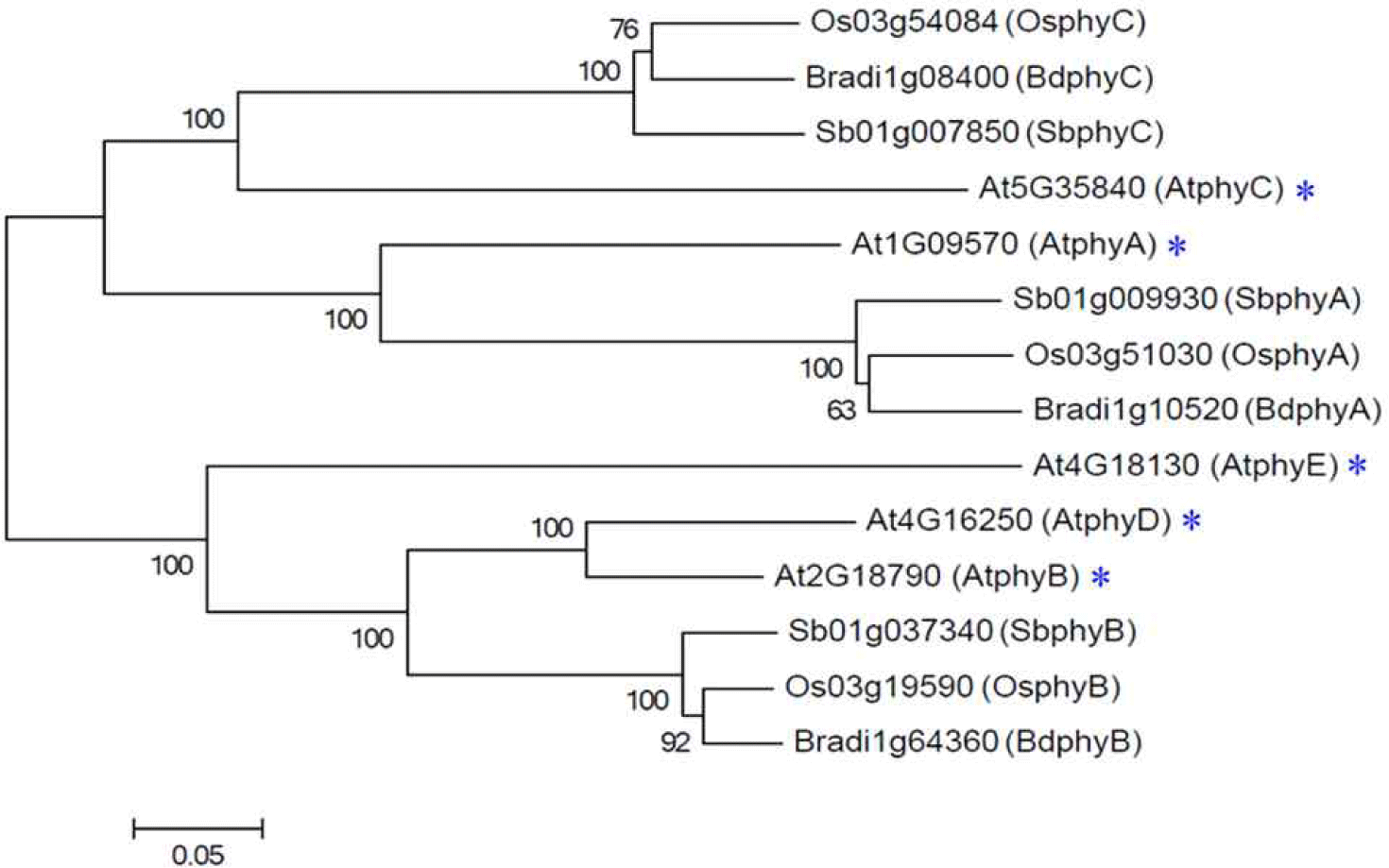
식물은 고착생물로서 광합성뿐만 아니라 주변의 광 환경 변화를 인식하고 이에 적응하기 위해 다양한 광수용체를 활용하여 생장과 발달을 정교하게 조절한다. 그중에서 파이토크롬(phytochrome)은 적색광 및 원적색광을 인식하는 주요 광수용체로, 식물의 다양한 생리학적 발달을 조절하는 데 필수적인 역할을 한다[1,2]. 통상, 고등 식물에는 3종의 파이토크롬(phyA-phyC)이 존재하지만, 모델 식물인 애기장대(Arabidopsis thaliana)에는 phyA부터 phyE까지 총 5종의 파이토크롬이 존재한다(Fig. 1). 참고로 phyD와 phyE는 애기장대를 포함한 십자화과 식물과 현화식물에 각각 국한되어 존재하는 것으로 알려졌다[3]. 이 중 phyA 광수용체는 식물의 원적색광 신호전달을 매개하고, phyB-phyE는 적색광 수용체로 알려졌다. 이 중에서 phyB가 주요한 적색광 수용체이며, phyC-phyE는 phyB의 기능을 보조하는 역할을 하는 것으로 보고되었다. 파이토크롬 연구의 중요성은 TAIR (The Arabidopsis Information Resource, https://www.arabidopsis.org)에서 발표한 논문에 가장 많이 사용된 식물 유전자 상위 20종 중에서 phyB는 1위, phyA는 4위에 있는 부분에서 확인할 수 있다(https://plantae.org/tairs-top-twenty-arabidopsis-genes-of-all-time). 따라서 식물 파이토크롬에 관한 연구는 1950년대 이후 지속적으로 진행되고 있으며, 이러한 연구는 광 환경 변화에 따른 식물의 적응 및 발달 체계를 이해하는 데 중요한 단서를 제공하고 있다.
파이토크롬은 두 개의 동일한 소단위체(protomer)로 이루어진 이량체(dimer) 형태로 존재하며, 각각의 소단위체에는 발색단으로 작용하는 파이토크로모빌린(phytochromobilin, PΦB)이 결합되어 있다[1,2]. 파이토크롬은 암 조건 또는 빛이 약한 조건에서 적색광을 흡수할 수 있는 Pr 불활성화 형태로 세포질에서 생합성되며, 이후 발색단이 빛을 흡수하면 원적색광을 흡수할 수 있는 Pfr 활성화 형태로 전환된다. 이러한 Pr-to-Pfr 광활성화를 계기로 파이토크롬은 세포질에서 핵으로 이동하여 하위 신호전달인자와의 단백질-단백질 상호작용을 거쳐 다양한 유전자의 발현을 조절한다[4,5]. 이러한 파이토크롬 신호전달 과정은 식물의 광형태형성(photomorphogenesis) 반응 조절에 필수적으로 작용한다. 예를 들어, 암 조건에서 발아한 식물은 암형태형성(skotomorphogenesis) 발달로 정단 갈고리(apical hook)가 직립해지고 떡잎이 닫히며 하배축이 신장되지만, 빛에 노출되면 탈황화(de-etiolation) 과정을 거쳐 떡잎이 열리고 하배축 신장이 억제되는 광형태형성 발달로 전환된다. 이러한 식물의 광 반응성은 하배축 길이나 떡잎의 각도와 같은 형태적 지표를 통해 정량적으로 분석할 수 있으며, 암형태형성 반응에서 광형태형성 반응으로 전환하는 능력은 궁극적으로 식물의 생장과 발달에 필수적이다. 이를 통해 파이토크롬은 종자 발아, 잎과 줄기의 성장, 광주기성(circadian rhythm), 음지 회피성(shade avoidance), 개화(flowering) 등 다양한 광형태형성 발달 과정뿐만 아니라 비생물적 스트레스(염분, 가뭄, 추위, 고온 등) 및 생물학적 스트레스 내성, 기공 개폐 조절, 광합성 및 식물 방어와 같은 폭넓은 생리적 반응에도 관여함에 알려졌다.
식물 연구에서의 중요성으로 말미암아 파이토크롬 구조-기능 연구는 경쟁적으로 연구되어 왔으며, 특히 3차원(3D) 단백질 구조를 밝히기 위한 노력이 오랜 기간 경주되어왔다. 하지만 비교적 큰 크기의 단백질(이량체 기준, 약 240 kDa 이상), 구조적 이질성(Pr 및 Pfr 형태 혼재) 등으로 X-ray crystallography 분석을 위한 단백질 결정 형성에 어려움이 있었다. 하지만 최근 극저온 전자 현미경(cryogenic electron microscopy, cryo-EM) 기술이 발전하면서, 애기장대 파이토크롬 단백질 구조가 속속 보고되고 있다[6]. 또한 최근 파이토크롬 기능 조절기전 중 하나로 인산화(phosphorylation)가 주목받고 있다[5,7]. 인산화는 단백질의 구조-기능을 변화시키는 중요한 생화학적 과정으로, 파이토크롬에 의한 식물의 광 반응성 조절에서 핵심적인 역할을 하는 것으로 인식되고 있다[5,8]. 이에 파이토크롬 분자 내 인산화가 실제 식물체 내에서 기능하는지, 그리고 광신호전달에서 어떤 역할을 하는지에 관한 연구가 꾸준히 진행되어 왔으며, 최근에서야 파이토크롬을 인산화시키는 단백질 키나아제(protein kinase)가 보고되었다[8]. 특히 파이토크롬 기능 규명에서 인산화 사이트 돌연변이체(site-mutant) 연구는 이러한 메커니즘 규명을 위한 중요한 단서를 제공할 수 있으며, 이는 궁극적으로 식물 생리학 및 농업생명공학 분야에서 광에 대한 작물의 적응력 향상을 통한 생산성 증대를 가능하게 하고, 분자육종 전략 개발에 기여할 것으로 여겨진다.
따라서 본 논문에서는 최근에 보고된 파이토크롬의 단백질 구조에 대한 소개와 더불어, 현재까지 알려진 파이토크롬 인산화 사이트 돌연변이체 연구 내용을 제시하고자 한다.
본 론
파이토크롬은 일반적으로 N-도메인의 광 감각 모듈(photosensory module, PSM)과 C-도메인의 출력 모듈(output module, OPM)로 구성되어 있다(Fig. 2a). 특히 구조적으로 Pr 형태에서는 무작위(random) 구조를 이루다가 광활성화 되어 Pfr 형태로 전환되면 α-나선(α-helix) 구조로 전환되는 N-말단 확장(N-terminal extension, NTE) 부위와, PSM 및 OPM을 연결하는 경첩(hinge) 부위가 있다. 그리고 PSM 내에는 photosensory core라 불리는 nPAS-GAF-PHY tri-domain이 있는데, GAF 도메인 내에 빛을 흡수하여 감지하는 발색단(PΦB)이 존재한다[9]. 참고로 nPAS 도메인은 단백질-단백질 상호작용 및 이량체 형성에 관여하며, PHY 도메인은 Pfr 안정화를 돕는 것으로 알려져 있다. OPM 내에는 구조적 안정성과 신호전달에 관여하는 PAS1 도메인, PSM과 상호작용하여 이량체 형성을 촉진하는 PAS2 도메인, 그리고 이량체 형성을 돕고 구조적 안정성을 제공하는 HKRD(histidine kinase-related domain) 도메인이 있다[10]. 또한 초기에 보고된 파이토크롬 PSM의 구조적 특징으로 nPAS-GAF 도메인 연결을 만드는 8자 매듭(knot loop 또는 knot lasso, KL), PHY 도메인에서 발색단 결합 부위의 GAF 도메인과 접촉하도록 돌출하는 헤어핀(hairpin, HP), 그리고 GAF와 PHY 도메인을 단단히 연결하는 나선형 기둥(helical spine) 등이 있다[9,11]. 이후에 전장(full-length) 파이토크롬 구조가 밝혀지면서 OPM 내의 PAS2 도메인이 PSM 내의 PHY 도메인 사이에 위치하여 구조적 결합 강화와 더불어 신호전달 민감성을 조절하는 루프(modulator loop, Mod)를 형성함이 알려졌다[12].
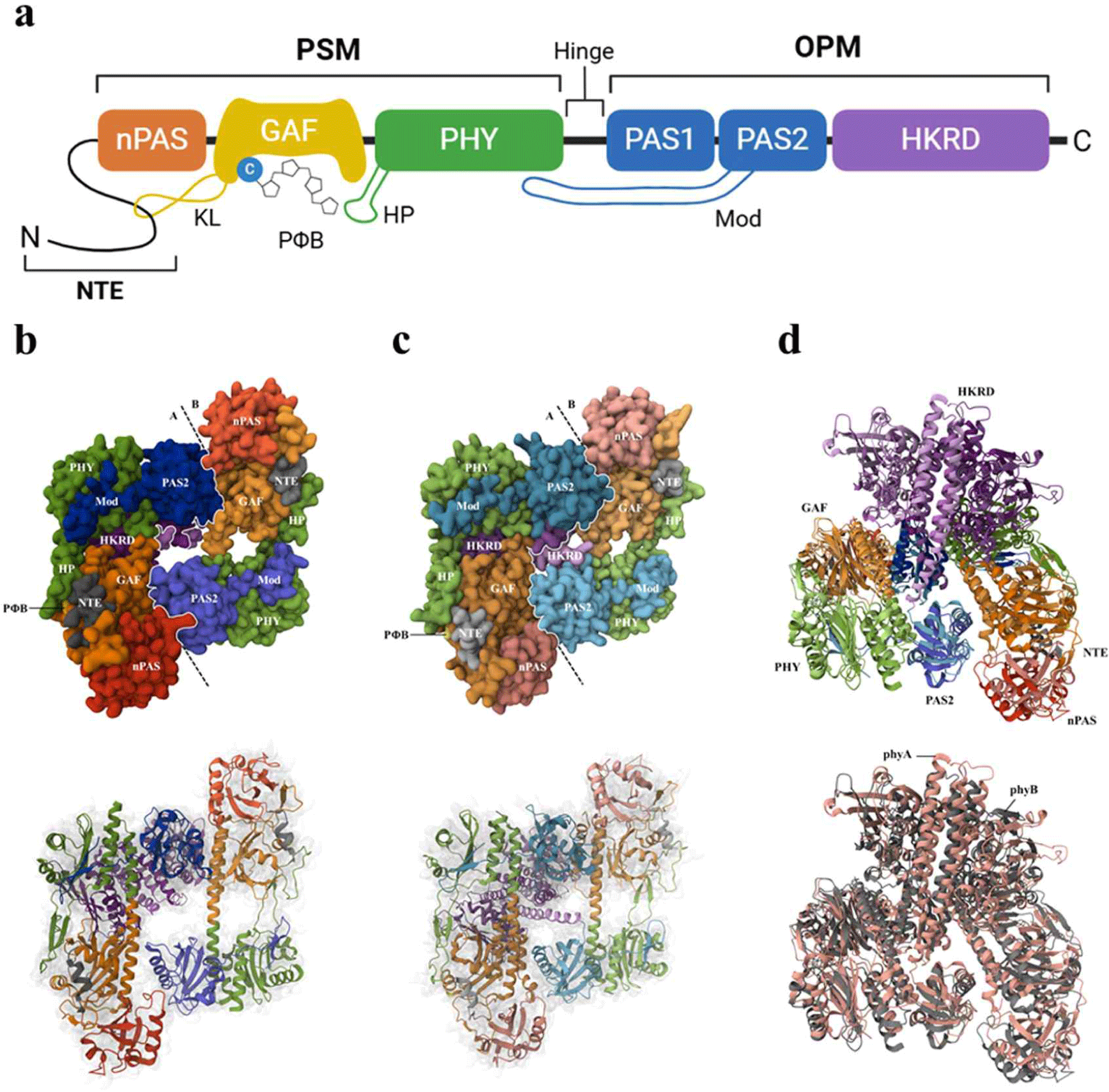
최근에 극저온 전자 현미경(cryo-EM)을 사용하여 전체 길이의 애기장대 phyB(AtphyB) 및 phyA(AtphyA) 구조가 처음으로 원자 수준에서 보고되었으며[12,13], 또한 파이토크롬과 파이토크롬 상호작용인자(phytochrome-interacting factor, PIF) 결합 구조도 보고되었다[14]. 이들 AtphyB 및 AtphyA 단백질의 3D 단백질 구조는 RCSB PDB(https://www.rcsb.org/)에 등록되었으며(접근 코드 7RZW 및 8F5Z), 이를 통해 전체 길이의 파이토크롬 단백질 원자 구조를 제시할 수 있었다(Fig. 2b and 2c). 보고된 결과를 살펴보면, 대칭적인 이량체 구조를 이룰 것으로 예측된 결과와 달리 AtphyB 구조는 비대칭적인 이량체임이 확인되었다[12]. 이때 AtphyB의 PSM은 이량체 구조에서 직접 접촉하지 않고 head-to-tail 방식으로 배열되어 단독으로는 이량체를 형성하지 않고 단량체(monomer)로 존재하며, 대신 PAS2 도메인과 PAS1 및 PAS2 도메인 사이에 있는 19개 아미노산으로 이루어진 β-헤어핀 구조(Mod)가 PSM이 이량체로 결합하는 데 중요한 역할을 하는 것으로 확인되었다. 또한 HKRD는 박테리아 파이토크롬 구조와 유사하게 head-to-head 방식으로 결합하여 이량체를 안정화하는 역할을 보여주었지만, PSM-PAS2 구조 플랫폼 위에 비대칭적으로 위치하여 각 프로토머(protomer)가 서로 다른 방향으로 약 53° 기울어져 있었다. 이 비대칭성은 각각의 프로토머가 고유한 신호전달 잠재력을 가지게 만드는 것으로 여겨지며, 특히 주목할 것은 두 프로토머를 소수성 및 전기적 상호작용으로 연결하는 PAS2와 nPAS/GAF 도메인 상호작용과 더불어, Mod-PHY 상호작용을 통해 PHY 도메인의 β-sheet를 확장하여 안정성을 제공하는 것이었다. 따라서 PAS2 도메인 및 Mod 모티브가 이량체 형성에 필수적이며, 이들 간의 상호작용은 AtphyB의 신호전달과 구조적 안정성을 유지하는데 핵심으로 작용하는 것으로 유추되었다. 또한 AtphyB의 이량체 형성은 Pfr 안정성 유지와 열 전환(thermal reversion) 속도 조절에도 필수적이며, AtphyB의 열 전환 속도는 PAS2-nPAS/GAF 상호작용과 Mod-PHY 상호작용에 의해 조절되는 것으로 추정되었다.
AtphyA는 AtphyB와 유사하게 PSM은 head-to-tail 방식으로 배열되고, HKRD가 head-to-head 방식으로 결합하여 이량체를 형성하였다[13]. 또한 AtphyB 구조와 유사하게, AtphyA 구조에서도 PAS2-nPAS/GAF 상호작용과 Mod-PHY 상호작용이 이량체 형성에 중요한 역할을 하였다. 그러나 AtphyA는 AtphyB와 달리 대칭적인 구조를 보여주었으며, 이는 두 파이토크롬 간 구조적 차이를 만들었다(Fig. 2d). 특히 HKRD와 head-to-tail 구조 플랫폼이 비대칭 구조를 형성하는 AtphyB와 달리, AtphyA는 HKRD가 head-to-tail 플랫폼이 거의 수직으로 위치하여 상호작용이 더 대칭적이고 균형 잡힌 형태로 이루어져, 상대적으로 더 안정적인 구조를 만드는 것으로 확인되었다. 이는 AtphyA가 AtphyB보다 더 느린 열 전환 속도를 보여주는 결과를 설명하며, 이 차이는 두 파이토크롬 간 기능적 차이에 대한 통찰을 제공하였다.
이러한 파이토크롬 구조를 연구한 결과들은 phyA와 phyB의 구조적 차이를 제공하여 phyA가 저광량 환경에서 높은 감광성을 유지하는 기전을 제시하고, phyB가 고광량 환경 및 온도 변화를 더 민감하게 감지하도록 진화했음을 보여주었다. 따라서 phyA와 phyB는 구조적 유사성을 공유하면서도, 각자의 생태적 요구에 맞춘 차별화된 기능적 특성을 보이고 있었다. 이들 결과는 파이토크롬의 기능을 이해하고 광 신호를 감지하여 식물의 생장과 발달을 조절하여 다양한 외부 환경에 적응하는 방식을 이해하는 데 중요한 단서를 제공하였다.
식물 파이토크롬이 인산화되는 단백질이라는 것은 1980년대에 보고되었으며, 이후 귀리(Avena sativa)에서 분리한 phyA(AsphyA) 단백질의 질량 분석을 통해 NTE 내의 8번 및 18번 세린(serine, S) 잔기와 hinge 내의 S599 잔기를 인산화 사이트로 동정하였다[15]. 이후 599번 세린 잔기를 알라닌(alanine, A)으로 치환시킨 돌연변이체(S599A)를 도입시킨 식물체를 분석한 결과, 파이토크롬 기능이 향상됨을 확인하였다[16]. 이 연구에서 AsphyA의 S599 인산화는 하위 신호전달인자와의 단백질-단백질 상호작용(protein-protein interaction)을 저해함을 확인하였으며, 이는 파이토크롬 인산화가 하위 신호전달인자와의 상호작용을 조절함을 제시하였다. 이후 S8 및 S18 잔기는 파이토크롬이 자체 보유한 단백질 키나아제 활성에 의해 자가인산화(autophosphorylation) 되는 사이트로 동정되었다[17]. 이 연구에서 S8/18A 돌연변이체 도입 식물의 광 반응성이 향상됨을 검증하였다. 이는 AsphyA 자가인산화는 AsphyA의 광에 의한 단백질 분해를 유도하여 식물체 내에서 광활성화된 AsphyA를 신속하게 제거하는 역할을 하여, 다음 광 신호를 새롭게 감지할 수 있도록 만드는(desensitization) 기능임을 제시하였다. 또한 애기장대 phyA(AtphyA) hinge 내의 세 아미노산 잔기를 알라닌으로 치환시켜 인산화가 일어나지 않도록 만든 돌연변이체(S590A/T593A/S602A)와 아스파르트산(aspartate, D)으로 치환시켜 인산화 형태로 만든 돌연변이체(S590D/T593D/S602D)를 도입시킨 식물체를 분석하여, 파이토크롬 기능이 감소함을 확인하였다[18]. 이 연구에서 이들 돌연변이체는 AtphyA가 핵으로 이동하는데 중요한 하위 신호전달인자인 FHY1(far-red elongated hypocotyl 1) 및 FHL(FHY1-like)과의 상호작용이 감소하고, AtphyA 단백질 안전성은 증가하였음을 보여주었다. 따라서 AtphyA의 hinge region 인산화는 빛에 의한 AtphyA 단백질 분해와 하위 신호전달인자와의 상호작용 조절에 중요함을 제시하였다. 이들 돌연변이체는 Table 1에 요약되어 있고, 인산화되는 위치와 기능을 최근 보고된 파이토크롬 구조 모델을 이용하여 제시하였다(Fig. 3a).
| Phytochromes | Domain | Mutant | Plant species | Activity | References |
|---|---|---|---|---|---|
| phyA | NTE | S8A | Avena sativa | + | [17] |
| S18A | |||||
| S8/18A | |||||
| Hinge | S599A | Avena sativa | + | [16] | |
| S590A/S602A | Arabidopsis thaliana | – | [18] | ||
| S590A/T593A/S602A | – | ||||
| S590D/T593D/S602D | – | ||||
| phyB | NTE | S86A | Arabidopsis thaliana | + | [19,20] |
| S86D | – | ||||
| S3/23-25A | n.d. | [20] | |||
| S3/23-25A/S86A | n.d. | ||||
| S3/23-25D | – | ||||
| S3/23-25/S86D | – | ||||
| NTE/nPAS | Y104E | – | [20,21] | ||
| Y104F | + | ||||
| S80/106A | – | [24] | |||
| S80/106D | + | ||||
| S106/227A | + | [25] | |||
| phyD | NTE | S82A | Arabidopsis thaliana | + | [20] |
| S88A | + | ||||
| S88D | – | ||||
| phyE | NTE | S50A | Arabidopsis thaliana | n.d. | [20] |
| S50D | – | ||||
| S53A | n.d. |
1) NTE, N-terminal extension; Hinge, the linking region between photosensory module (PSM) and output module (OPM); nPAS, N-terminal Per/Arnt/Sim domain.
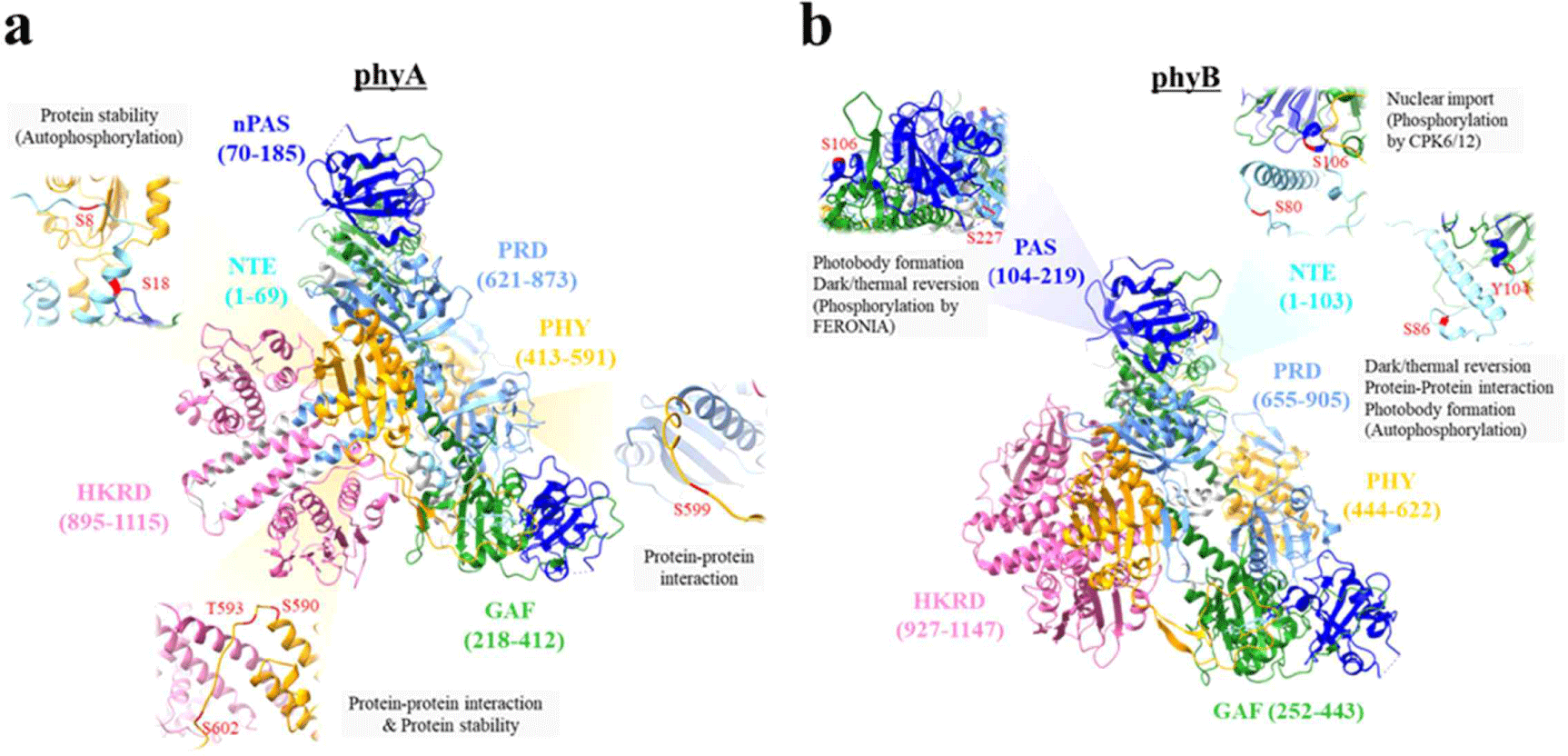
그리고 phyB 인산화 돌연변이체의 경우 대부분 애기장대 phyB(AtphyB)를 이용하여 연구가 진행되었다(Table 1, Fig. 3b). 초기 연구는 질량 분석을 통해 동정된 AtphyB 인산화 사이트 중에서 NTE 내의 S86 잔기를 알라닌 또는 아스파르트산으로 치환시킨 돌연변이체(S86A & S86D)를 도입시킨 식물체를 분석하였으며, 결론적으로 S86A 돌연변이체는 AtphyB 기능이 향상되었고 S86D 돌연변이체는 기능이 감소하였다[19]. 이 연구에서 AtphyB의 S86D 돌연변이체는 불활성화 기전 중의 하나인 암 전환(dark reversion) 또는 열 전환(thermal reversion)을 빠르게 만드는 것을 보여주었다. 즉, 암 또는 열 전환(dark/thermal reversion)은 AtphyB의 활성화 Pfr 형태를 불활성화 Pr로 복귀시켜 AtphyB 기능을 감소시킨다. 이에 인산화가 되지 않아 Pfr-to-Pr 전환 속도가 느려진 S86A 돌연변이체는 활성이 높고, 인산화 형태를 만드는 S86D 돌연변이체는 Pfr-to-Pr 전환 속도가 빨라져 활성이 낮았다. 따라서 AtphyB의 NTE 부위 인산화는 Pfr-to-Pr 전환(dark/thermal reversion)을 가속해 기능을 감소시키는 기작임을 제시하였다. 다음 연구에서는 S86 잔기와 더불어 식물체에서 AtphyB 인산화 사이트로 동정된 다수의 사이트(S3, S23, S24, S25)를 알라닌 또는 아스파르트산으로 치환시킨 돌연변이체(S3/23-25A, S3/23-25A/S86A, S3/23-25D, S3/23-25D/ S86D)를 도입시킨 식물체를 분석하였으며, 결론적으로 S3/23-25A 돌연변이는 S86A 돌연변이체가 보인 고활성을 억제하였으며, S3/23-25D 돌연변이는 S86D 돌연변이체처럼 활성이 현저하게 감소시켰다[20]. 그리고 식물에서는 티로신(tyrosine) 잔기의 인산화는 매우 드물게 관찰되는데, 흥미롭게도 AtphyB에서 NTE와 nPAS를 연결하는 부위의 Y104 잔기의 인산화가 보고되었다[20,21]. 이 연구에서 인산화 형태를 만드는 Y104E 돌연변이체는 AtphyB 기능을 감소시켰고, 인산화가 되지 않는 Y104F 돌연변이체는 기능을 향상시켰으며, 이는 PIF3(phytochrome-interacting factor 3)과 같은 하위 신호전달인자와의 상호작용과 Pfr-to-Pr 전환 속도와 연관됨이 제시되었다. 종합적으로, 이들 연구를 통해 NTE 인산화가 AtphyB 기능 조절에 중요함을 다시 한번 제시할 수 있었다.
파이토크롬이 인산화되는 단백질이기에, 인산화시키는 단백질 키나아제는 필수적으로 존재하여야 한다. 하지만 오랜 기간의 연구에도 불구하고 한동안 파이토크롬을 인산화시키는 단백질 키나아제는 동정되지 못하였으며, 오직 파이토크롬이 자체 보유한 키나아제 활성에 의한 자가인산화만 연구되어왔다[22,23]. 하지만 최근 AtphyB를 인산화시키는 키나아제가 동정되어 연달아 보고되고 있다. 그중 하나는 CPK6(calcium dependent protein kinase 6) 및 CPK12 키나아제가 AtphyB의 S80 및 S106 잔기를 인산화시킴을 확인하였다[24]. 이 연구에서 인산화가 되지 않는 AtphyB의 S80/106A 돌연변이체는 고활성을, 인산화 형태를 만드는 S80/106D 돌연변이체는 저활성을 보임을 증명하였다. 그리고 CPK6/12에 의한 S80/S106 인산화는 AtphyB의 핵으로의 이동(nuclear translocation) 조절에 있어 매우 중요한 메커니즘임을 제시하였다. 또 다른 키나아제는 세포막에 존재하는 FERONIA(FER) 단백질로, 세포질에 있는 키나아제 도메인이 AtphyB의 PSM과 상호작용하여 S106 및 S227 잔기를 인산화시킴을 확인하였다[25,26]. 이 연구에서 인산화가 되지 않는 S106/227A 돌연변이체는 AtphyB의 활성을 높였는데, 이는 핵 내의 photobody 형성을 돕고 Pfr-to-Pr 전환 속도를 느리게 하는 기전으로 이루어졌다. 따라서 AtphyB의 NTE 내에는 다수의 인산화 사이트가 존재하며, 이들 사이트 인산화는 Pfr-to-Pr 전환 속도 조절을 포함하여, 핵으로의 이동성 및 하위 신호전달인자와의 상호작용 등의 조절을 통해 phyB 기능을 제어하는 것으로 여겨진다.
파이토크롬의 인산화 연구는 대부분 phyA 및 phyB를 대상으로 진행되었으나, 애기장대 phyD 및 phyE의 NTE 내 세린 잔기를 대상으로도 연구가 진행되었다[20]. AtphyB에서 가장 두드러진 표현형을 보여주었던 S86A 돌연변이체에 해당하는 AtphyD의 S88A(S82A 포함)도 향상된 파이토크롬 기능을 보여주었다. 그리고 AtphyB의 S86D 돌연변이체에 해당하는 AtphyD의 S88D 및 AtphyE의 S50D 돌연변이체는 모두 감소된 기능을 보여주었다. 따라서 파이토크롬 NTE 인산화는 모든 식물 파이토크롬에 존재하는 것을 추정할 수 있었다. 다만, phyA 및 phyB에서 NTE 인산화의 결과는 매우 달랐는데, phyA의 NTE 인산화는 주로 단백질 안정성 조절에 중요하였고, phyB를 포함한 다른 파이토크롬에서는 Pfr-to-Pr 전환, 핵으로의 이동성, 단백질-단백질 상호작용 등의 조절에 중요한 것으로 확인되었다. 흥미로운 부분으로 phyA에서는 단백질 안정성뿐만 아니라 단백질-단백질 상호작용 조절에 중요한 hinge 부위 인산화가 확인되었지만, 아직 phyB나 다른 파이토크롬에서는 hinge 인산화가 보고되지 않았다. 실제 phyB에서 hinge region 인산화가 이루어지지 않는지, 아니면 아직 보고되지 않은 또다른 단백질 키나아제가 있는지는 향후 규명되어야 할 연구 주제로 여겨진다.
이상의 연구 결과들을 종합해 보면, 최소한 모든 파이토크롬의 NTE 내에는 인산화 사이트가 존재하며, 이는 오래전 제시된 파이토크롬이 인산화되는 단백질이라는 결과와 일치하고 있다. 그리고 NTE 인산화는 파이토크롬 기능을 조절할 수 있는 모든 조절기전과 연동되어 있음을 확인할 수 있다. 여기에는 phyA의 단백질 안정성 및 하위 신호전달인자와의 상호작용 조절, phyB의 Pfr-to-Pr 전환 속도, 핵으로의 이동성 및 photobody 형성, 단백질-단백질 상호작용 조절 등이 포함된다. 어떻게 인산화가 이렇게 다양한 조절기전을 보이는지에 관한 연구는 추후 진행되어야 할 주제로 여겨지는데, 이와 관련하여 최근 활발하게 연구되고 있는 상 분리(phase separation) 기전에 주목할 필요가 있을 것으로 여겨진다[27]. 이는 파이토크롬이 빛에 의해 활성화 되면 핵으로 들어가고 photobody를 형성하면서 기능하는데, 이때 photobody 형성 과정이 상 분리 과정으로 추정되기 때문이다. 실제 최근에 보고된 논문에서 phyB의 NTE가 액체-액체 상 분리(liquid-liquid phase separation)에서 중요한 역할을 하며, 이를 통해 식물의 광형태형성 및 고온형태형성(thermomorphogenesis) 조절에 관여함이 제시되었다[28]. 따라서 향후 NTE 인산화와 상 분리 기전의 연관성에 대한 연구가 필요할 것으로 여겨진다.
결 론
파이토크롬은 적색 및 원적색 광수용체로서 광형태형성 조절에 관여하는 중요한 단백질이다. 모델 식물로 이용되는 애기장대에는 5종의 파이토크롬이 존재하며(AtphyA-AtphyE), 그중에서 원적색광을 감지하는 AtphyA와 적색광을 감지하는 AtphyB가 지금까지 광범위하게 연구되었다. 구조-기능 연구는 단백질의 조절 기능을 이해하는 데 필수적인데, 최근에서야 극저온 전자 현미경을 이용하여 전체 길이의 파이토크롬 단백질 구조가 보고되었다. AtphyA 및 AtphyB 원자 구조를 통해, N-말단의 광 감각 모듈(PSM)은 head-to-tail 방식으로 배열되고 C-말단 출력 모듈(OPM)의 HKRD는 head-to-head 방식으로 결합하여 이량체를 형성하는 것을 확인하였다. 그리고 AtphyA는 대칭적인 단백질 구조를 보여주었지만, AtphyB는 비대칭적인 이량체로 확인되었다. 이는 AtphyA의 단백질 구조가 AtphyB 보다 더 안정임을 시사하였다. 파이토크롬의 구조적 특징으로, N-말단의 확장(NTE) 영역과 더불어, PSM 및 OPM을 연결하는 경첩(hinge) 영역이 있다. 흥미롭게도, 파이토크롬의 NTE 및 hinge 영역에 인산화되는 아미노산 잔기들이 보고되었다. 이후의 연구를 통해, 파이토크롬A(phyA) 인산화는 단백질의 안정성 및 단백질-단백질 상호작용에 중요함을 제시하였다. AtphyB, AtphyD 및 AtphyE의 경우, NTE 내에 인산화가 암/열 전환 속도, 핵으로의 이동성 및 photobody 형성, 단백질-단백질 상호작용 등을 조절하는 데 관여함이 제시되었다. 모든 파이토크롬의 NTE 내에 인산화 사이트가 존재하기에 인산화에 의한 조절의 중요성을 제시하고 있으며, 이러한 기능적 유사성은 파이토크롬 패밀리 내에서 보존된 조절 메커니즘이 존재함을 시사하고 있다.






