서 론
뜰보리수(Elaeagnus multiflora, cherry silverberry)는 보리수나무과(Elaeagnaceae) 보리수나무속(Elaeagnus)으로, 한국, 중국, 일본에서 주로 관상용 또는 과수로 재배되고 있다[1]. 뜰보리수 열매는 단맛을 가지고 있으나, 떫은맛이 매우 강하다[2,3]. 이로 인해 당절임, 초절임 및 농축액과 같은 방법으로 가공하여 뜰보리수청, 식초 및 음료로 이용되고 있다[3–5]. 또한, 뜰보리수열매는 한방에서 목반하라고 불리며, 설사와 출혈을 멎게 하고 소화불량, 골수염, 부종 등에 약효가 있다고 알려져 있다[2,3]. 뜰보리수 열매는 gallic acid, p-coumaric acid, vanillic acid, p-hydroxybenzoic acid, protocatechuic acid, epicatechin, epigallocatechin, catechin gallate, gallocatechin gallate 및 epigallocatehin gallate 등과 같은 유용 페놀성 화합물이 함유되어 있고, 항산화, α-glucosidase 저해, 혈소판 응집 억제, 항염증, 그리고 암세포 증식 억제 활성 등의 일부 생리활성을 발휘한다고 보고되고 있다[1,4–7]. 뜰보리수 열매는 과육이 쉽게 손상되기 때문에 과일로써 주목받지 못하고 있다. 그러므로 뜰보리수 열매를 활용한 가공식품에 대한 체계적인 연구가 요구된다.
식초는 우리나라에서 된장, 고추장, 간장 등과 같은 장류 다음으로 널리 이용되고 있으며, 젖산 분해 촉진, 콜레스테롤 저하 및 체지방 감소, 젖산 분해에 따른 피로회복 등의 다양한 효과가 있다고 보고되고 있다[8–10]. 식초는 일반적으로 알코올 및 초산 발효를 거쳐 제조되며, 곡류 또는 과실 등의 식품소재들을 이용하여 다양한 종류의 식초를 생산하고 있다[11]. 이러한 식초는 신맛을 내는 acetic acid가 주성분으로, 그 외 유기산 및 아미노산을 포함한 다양한 유용성분을 함유하고 있는데, 식초 원료로 사용되는 식품소재에 따라 그 유용 성분 및 그 함량이 다르다[9,11,12]. 뜰보리수 열매를 이용하여 식초를 제조하는 동안 발효특성, catechin류와 phenolic acid류의 함량 변화, 그리고 항산화 및 α-glucosidase 저해 활성을 보고한 바 있다[4]. 그러나 뜰보리수 열매를 이용하여 식초를 제조하는 동안 catechin류와 phenolic acid류를 포함한 다양한 비휘발성 대사체들의 변화에 대한 연구는 미흡한 실정이다.
따라서 본 연구에서는 뜰보리수 열매를 이용한 자연 발효 식초를 제조하는 동안 발효 기간에 따른 발효 특성을 파악하고자 하였다. 또한, liquid chromatography-electrospray ionization quadrupole/time-of-flight mass spectrometry(LC-ESI-QTOF-MS)를 이용하여 비표적 비휘발성 대사체 분석을 통해 발효기간에 따른 뜰보리수 열매 식초의 대사체 변화를 이해하고자 하였다.
재료 및 방법
뜰보리수(E. multiflora) 열매는 2023년 6월에 경상남도 함안군에서 채취한 것을 구입하여, 실험에 사용하였다. 물로 세척한 뜰보리수 열매 20 kg을 8 h 동안 중탕으로 살균한 다음, 설탕용액(sugar/water=10:1, w/v) 80 L를 첨가하여 상온에서 2일 간격으로 1회 교반하면서 15일 동안 자연 발효시켰다. 이어 상온에서 20일 동안 에탄올 발효를 진행한 다음 씨앗이나 껍질 등의 불용물질을 제거하였으며, 그 여액을 약 5개월 동안 상온에서 초산 발효시켜 뜰보리수 열매 식초를 제조하였다. 뜰보리수 열매 식초를 제조하는 동안 발효 15일, 25일, 35일 그리고 180일에 시료를 채취하였다. 발효 기간에 따라 채취한 뜰보리수 열매 식초 발효액을 –75℃에 보관한 다음, 총 페놀성 화합물 및 총 flavonoid 함량, 항산화 활성 그리고 대사체 분석 등의 실험에 사용하였다.
색도는 표준백색판(L=96.0, a=–0.4, b=4.1)으로 보정한 색차계(CR-400, Konica Minolta, Japan)를 이용하여 명도(L, lightness), 적색도(+a, redness; –a, greenness), 황색도(+b, yellowness; –b, blueness)를 측정하였다. 뜰보리수 열매 식초 발효액의 pH는 pH meter(Orion star A111, Thermo Fisher Scientific, USA)를 이용하여 측정하였다. 또한, 총산도는 뜰보리수 열매 식초 발효액 10 mL에 0.1N NaOH 용액을 가하여 pH 8.3까지 적정하였으며, 식 (1)을 이용하여 초산의 양으로 환산하였다.
V: 0.1 mol/L NaOH의 소비량(mL)
F: 0.1 mol/L NaOH의 factor
D: 희석배수
S: 시료 채취량(mL)
뜰보리수 열매 식초 발효액의 총 페놀성 화합물 함량은 Folin & Ciocalteu’s 방법[13]을 약간 변형하여 측정하였다. 즉, 식초 발효액 10 μL에 증류수 90 μL와 2N Folin & Ciocalteu phenol 시약 50 μL를 가한 다음 상온에서 3 min 동안 반응시켰다. 이 반응용액에 25% Na2CO3 용액 50 μL를 가한 다음 25℃에서 1 h 동안 암소에 반응시켰다. 최종 반응용액의 흡광도는 microplate spectrophotometer(Mobi, MicroDigital, Korea)를 이용하여 735 nm에서 흡광도를 측정하였다. 식초 발효액의 총 페놀성 화합물의 함량은 표준물질인 gallic acid를 이용하여 작성된 검량곡선[μg gallic acid equivalent (GAE)/mL]을 이용하여 구하였다.
뜰보리수 열매 식초 발효액의 총 flavonoid 함량 측정은 Lee et al.[5]의 방법을 변형하여 측정하였다. 즉, 식초 발효액 20 μL, diethylene glycol 200 μL, 그리고 1N NaOH 용액 10 μL를 혼합한 다음, 37℃ dry oven에서 1 h 동안 반응시켰다. 이 반응 용액을 microplate spectrophotometer를 이용하여 420 nm에서 흡광도를 측정하였다. 식초 발효액의 총 flavonoid 함량은 표준물질인 quercetin을 이용하여 작성된 검량곡선[μg quercetin equivalent (QE)/mL]을 이용하여 측정하였다.
뜰보리수 열매 식초 발효액의 ABTS+radical scavenging 활성을 측정하기 위해, 7.4 mM ABTS 용액과 2.45 mM K2S2O8=1:1 (v/v)을 암실에서 16 h 동안 반응시켜 ABTS+ radical을 생성시켰으며, 이 용액의 흡광도값이 732 nm에서 0.7±0.02가 되도록 에탄올로 희석하였다. 뜰보리수 식초 발효액 20 μL와 ABTS+ radical 용액 180 μL를 혼합하여 5 min 동안 반응시킨 다음, microplate spectrophotometer를 이용하여 732 nm에서 흡광도를 측정하였다. 뜰보리수 열매 식초 발효액의 ABTS+ radical scavenging 활성은 trolox를 표준물질로 하여 작성된 표준곡선을 이용하여 측정되었으며, 이를 trolox 상당량[μM trolox equivalent (TE)/mL]으로 환산하였다.
뜰보리수 열매 식초 발효액의 FRAP을 측정하기 위해, 0.3 M 아세트산나트륨 완충용액(pH 3.6), 10 mM TPTZ 및 20 mM FeCl3·6H2O=10:1:1(v:v:v)로 혼합한 FRAP 용액을 실험 직전에 제조하였다. 뜰보리수 식초 발효액 20 μL와 FRAP 용액 200 μL를 혼합하여 37℃ dry oven에서 5 min 동안 반응시킨 다음, microplate spectrophotometer를 이용하여 593 nm에서 흡광도를 측정하였다. 식초 발효액의 FRAP value 활성은 trolox를 표준물질로 하여 작성된 표준곡선을 이용하여 측정되었으며, 이를 trolox 상당량[μM trolox equivalent (TE)/mL]으로 환산하였다.
뜰보리수 열매 식초 발효액을 원심분리(2,644×g, 20 min, 25℃)한 후 얻어진 상등액 10 mL에 ethyl acetate(EtOAc) 10 mL를 가하여 용매 분획을 하였다. 얻어진 EtOAc층 2 mL를 감압 농축한 다음 LC-MS(liquid chromatography-mass spectrometry) 대사체 분석에 사용하였다. 발효 기간이 다른 뜰보리수 열매 식초의 대사체 분석은 Song et al.[14]이 보고한 UPLC-ESI-QTOF-MS (UPLC, Acquity UPLCTM system; ESI-QTOF-MS, Xevo G2-XS QTOF; Waters MS Technologies, UK) 분석 방법을 약간 변형하여 실시하였다. 즉, UPLC column은 Acquity UPLCⓇ HSS T3(1.8 μm, 2.1×50 mm, Waters)이었으며, 0.1% formic acid가 함유된 H2O(A)와 acetonitrile(B)를 이동상 용매는 linear gradient 방법(0–2.0 min, 0% B → 2.0–16.0 min, 35% B → 16.0–24.0 min, 50% B → 24.0–27.0 min → 100% B)으로 용출하였다. 이때 유속은 0.35 mL/min로, column temperature는 40℃로, 그리고 대사체들 검출은 photodiode array(PDA)로 하였다. MS 분석 조건은 ion source로 electrospray ionization(ESI; positive, negative), capillary voltage(2.5 kV), cone voltage(40 V), 그리고 collision energy는 6 eV(low), 25–50 eV(high)로 하였다. Quality control(QC)은 발효 기간이 다른 뜰보리수 열매 식초를 동일량으로 혼합한 다음 10회 반복하여 LC-MS 분석을 진행하였다. 대사체들은 LC-MS 분석 결과로 얻어진 mass값, UV spectrum 및 MS/MS fragment ion을 기반으로 Massbank(https://massbank.eu/MassBank) 및 Human metabolome databases(HMDB, https://www.hmdb.ca)를 활용하여 실시하였다. 발효 기간이 다른 뜰보리수 열매 식초 발효액 대사체의 다변량 통계 분석은 MetaboAnalyst 6.0 (https://www.metaboanalyst.ca/MetaboAnalyst/)을 통해 Partial least squares discriminant analysis(PLS-DA) 및 Heatmap을 사용하여 데이터를 시각화 하였으며, One-way ANOVA를 통하여 p<0.05로 하였다.
결과 및 고찰
발효 기간에 따른 뜰보리수 열매 식초의 색도, pH 및 총산도 변화는 Table 1에 나타내었다. 색도는 외관상 품질을 판정하는데 중요한 요인 중 하나로, 명도를 나타내는 Hunter L값은 발효가 진행됨에 따라 지속적으로 감소하는 경향이었다. Hunter a값은 발효 전 녹색도를 나타냈으며 발효가 진행됨에 따라 녹색도가 높아졌으나 최종 발효일에는 발효 초기와 거의 유사하였다. 황색도를 나타내는 Hunter b값은 발효 180일의 식초 발효액이 13.57±0.14로 가장 높았으며 발효가 진행됨에 따라 높아지는 경향이었다. 본 연구 결과는 식초 제조 과정 중 Maillard 반응물들이 생성되어 명도는 감소하고 황색도는 증가한다는 보고와 매우 유사하였다[15]. 또한, 발효 기간 중 flavonoid류를 포함한 페놀성 화합물들의 산화로 인해 뜰보리수 열매 식초의 황색도가 증가한 것으로 해석된다.
발효 초기인 15일째 뜰보리수 열매 식초 발효액의 pH는 3.20±0.01이었으며, 발효가 진행되는 동안 유의적으로 감소하다가 최종 발효인 180일 발효액의 pH는 2.81±0.01이었다. 총산도의 경우 발효 15일째 발효액이 1.34±0.01%로 가장 낮았으며, 발효가 진행됨에 따라 지속적으로 증가하여 발효 180일째 발효액의 총산도는 4.17±0.03%이었다. 초산 발효는 발효가 진행됨에 따라 acetic acid를 비롯한 유기산 생성으로 인해 pH는 감소하고 총산도는 증가하는데[4,16], 뜰보리수 열매를 이용한 식초 발효 또한 유사한 경향임을 알 수 있었다. 뜰보리수 열매 식초의 총산도는 4.17%를 나타내 국내 발효 식초(4% 이상) 규격에 적합한 것으로 판단된다[17].
Phenolic acid류나 lignan류를 비롯한 페놀성 화합물은 식물계에 널리 분포하는 2차 대사산물로, 항산화, 항염증, 항암 등 다양한 생리활성을 발휘한다고 보고되고 있다[18,19]. 또한, 이러한 화합물들은 발효과정 중 미생물 작용 또는 산화에 의해 변화된다고 잘 알려져 있다. 이에 발효 기간 중 뜰보리수 열매 식초의 총 페놀성 화합물 함량 변화를 측정하였으며, 그 결과를 Fig. 1A에 제시하였다. 뜰보리수 열매 식초의 총 페놀성 화합물의 함량은 발효 15일째 219.3±1.85 μg GAE/mL로 가장 낮았으며, 발효가 진햄됨에 따라 점진적으로 증가하였으며, 발효 180일째 501.7±2.38 μg GAE/mL로 가장 높았다.
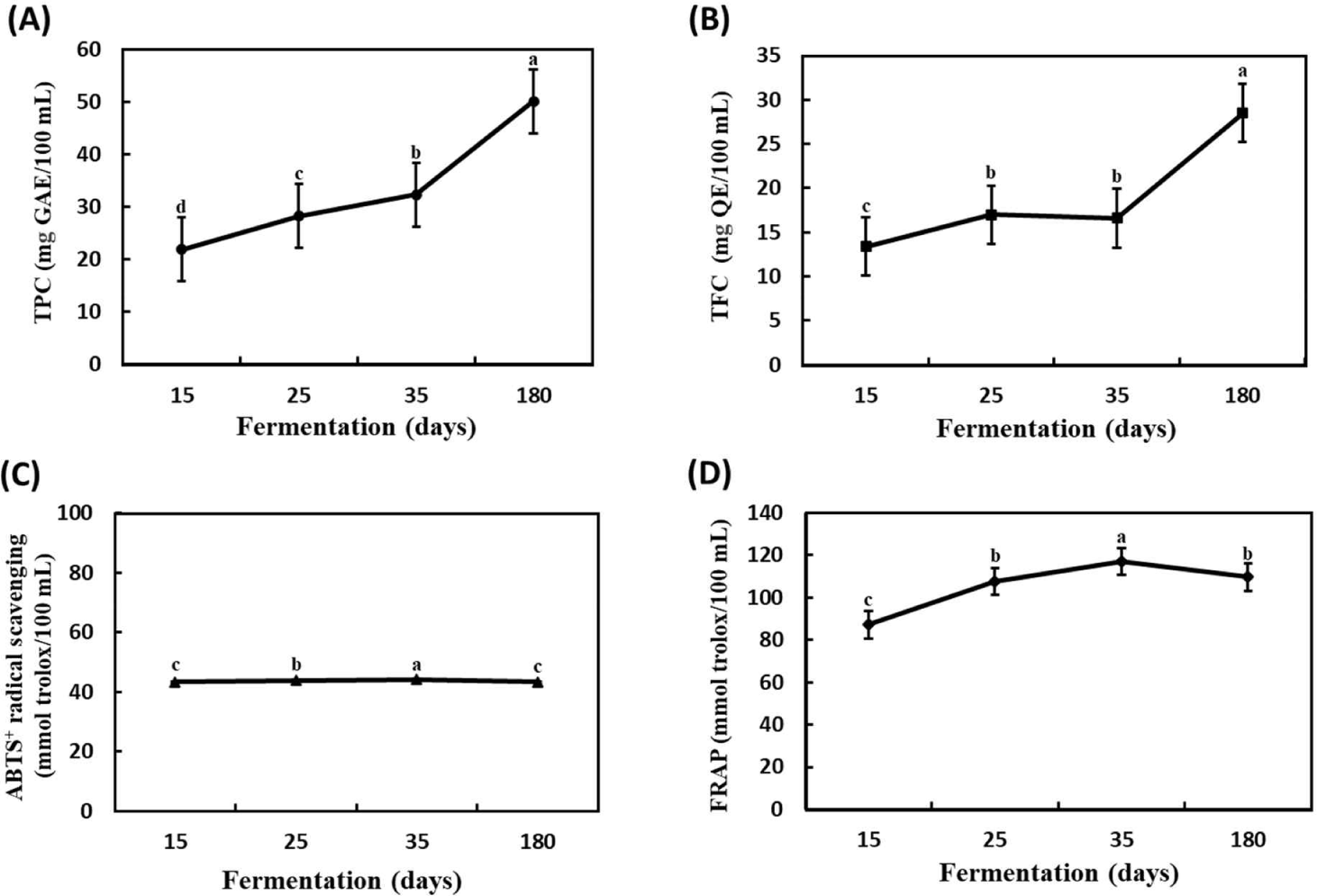
Flavonoid류는 페놀성 화합물 중 하나로, 항산화, 혈관개선, 장기능 개선 등의 다양한 생리활성을 발휘한다고 잘 알려져 있다[20]. 식품의 총 flavonoid 함량은 건강 기능성을 나타내는 지표인자로 널리 이용되고 있다. 이에 발효 과정 동안 뜰보리수 열매 식초의 총 flavonoid 함량 변화를 조사하였으며, 그 결과를 Fig. 1B에 제시하였다. 뜰보리수 열매 식초의 총 flavonoid 함량의 경우 발효 초기인 15일째에는 13.36±0.67 mg QE/100 mL으로 가장 낮았으며, 발효가 진행되면서 점진적으로 증가하였으며, 그리고 발효 180일째에 285.2±5.36 μg QE/mL로 가장 높았다. 초산 발효 과정 중에 페놀성 화합물들은 보통 분해되거나 변형되어 총 페놀성 화합물 및 flavonoid 함량이 감소한다고 보고되었다[21–22]. 그러나, 본 연구에서는 뜰보리수 열매 식초를 제조하는 동안 총 페놀성 화합물 및 총 flavonoid 함량이 지속적으로 증가한다고 보고한 결과[4]와 유사하였다.
Phenolic acid류나 flavonoid류를 포함한 페놀성 화합물은 채소류나 과실류와 같은 식품 소재에 널리 분포되어 있고, 활성산소 및 free radical 소거뿐만 아니라 metal chelating과 같은 항산화 활성이 우수한 화합물로 보고되고 있다[23,24]. 뜰보리수 열매를 이용하여 식초를 제조하는 동안 항산화 활성 변화를 파악하고자 ABTS+radical scavenging 활성 및 철환원력(FRAP)을 조사하였다. 그 결과, ABTS+radical scavenging 활성(Fig. 1C)은 발효 초기인 35일째(441.4±0.53 μmol TE/mL)까지 증가한 다음, 이후 약간 감소하는 경향이었으며, 최종 발효인 180일째 433.8±1.82 μmol TE/mL로 나타났다. FRAP(Fig. 1D)는 ABTS+radical scavenging 활성 변화와 유사하게 발효 35일째까지 증가하였다가 발효 180일째 다소 감소하는 경향임을 알 수 있었다. 즉, FRAP은 발효 15일째 871.4±19.32 μmol TE/mL, 발효 35일째 1,170.8±42.39 μmol TE/mL, 그리고 발효 180일째 1,095.9±32.92 μmol TE/mL로 나타났다. 뜰보리수 열매 식초의 항산화 활성은 발효 60일까지 점진적으로 증가한다고 보고되었으며[4], 이는 본 실험 결과와 유사하였다. 그러나, 뜰보리수 열매 식초의 발효 종료 시점인 180일째에서는 총 페놀성 화합물 및 총 flavonoid 함량이 가장 높았음에도 불구하고 항산화 활성은 다소 낮았다. 그러므로 뜰보리수 열매를 이용하여 식초를 제조하는 동안 phenolic acid류나 flavonoid류를 포함한 페놀성 화합물 변화가 항산화 활성에 영향을 준 것으로 판단되어, 이에 대한 보다 상세한 정보를 얻고자 LC-MS 기반 비표적 비휘발성 대사체 변화를 조사하였다.
뜰보리수 열매 식초를 제조하는 동안 대사체 변화 양상을 파악하고자, UPLC-ESI-QTOF-MS를 이용하여 비휘발성 대사체 분석을 실시하였다. 그 결과, 뜰보리수 열매 식초의 LC-MS TIC chromatograms에서 59종의 주요 화합물들이 관찰되었다(Fig. 2). 이들의 MS spectra를 기반으로 online database와 비교를 통해 chemical library를 실시한 결과(Table 2), 뜰보리수 열매 식초에는 succinic acid, isopropylmalic acid 등의 다량의 유기산들을 비롯하여 caffeic acid, coumaric acid 등의 phenolic acid류, leucine의 대사산물인 leucic acid류, 그리고 kaempferol, quercetin 등의 flavonol류가 주요 대사체들로 동정되었다. 이러한 대사체들은 과일 식초의 주요 성분으로 보고된 결과[25]와 유사하였다. 뜰보리수 열매 식초에서는 gallic acid, p-coumaric acid, vanillic acid, p-hydroxybenzoic acid, protocatechuic acid 등의 다수의 phenolic acid류가 존재하고 있음을 본 연구를 통해 재차 확인되었다. 그러나 뜰보리수 열매 식초에서 동정된 바 있는 epicatechin, epigallocatechin, catechin gallate, gallocatechin gallate 및 epigallocatehin gallate 등과 같은 catechin류는 본 실험의 LC-MS 비휘발성 대사체에서 동정되지 않았다[4]. 이는 본 실험에 사용한 뜰보리수 열매에 catechin류가 미량으로 함유하고 있어 검출되지 않은 것으로 사료된다. 흥미롭게도, 뜰보리수 열매 식초에서는 다른 과일 식초들과 달리 tricoumaroyl spermidine류가 존재하고 있음을 알 수 있었다. 본 연구팀은 뜰보리수 열매로부터 3종의 tricoumaroyl spermidine류를 분리하여 그 구조를 MS 및 NMR 분석을 통해 확인할 수 있었다(데이터 미제시).

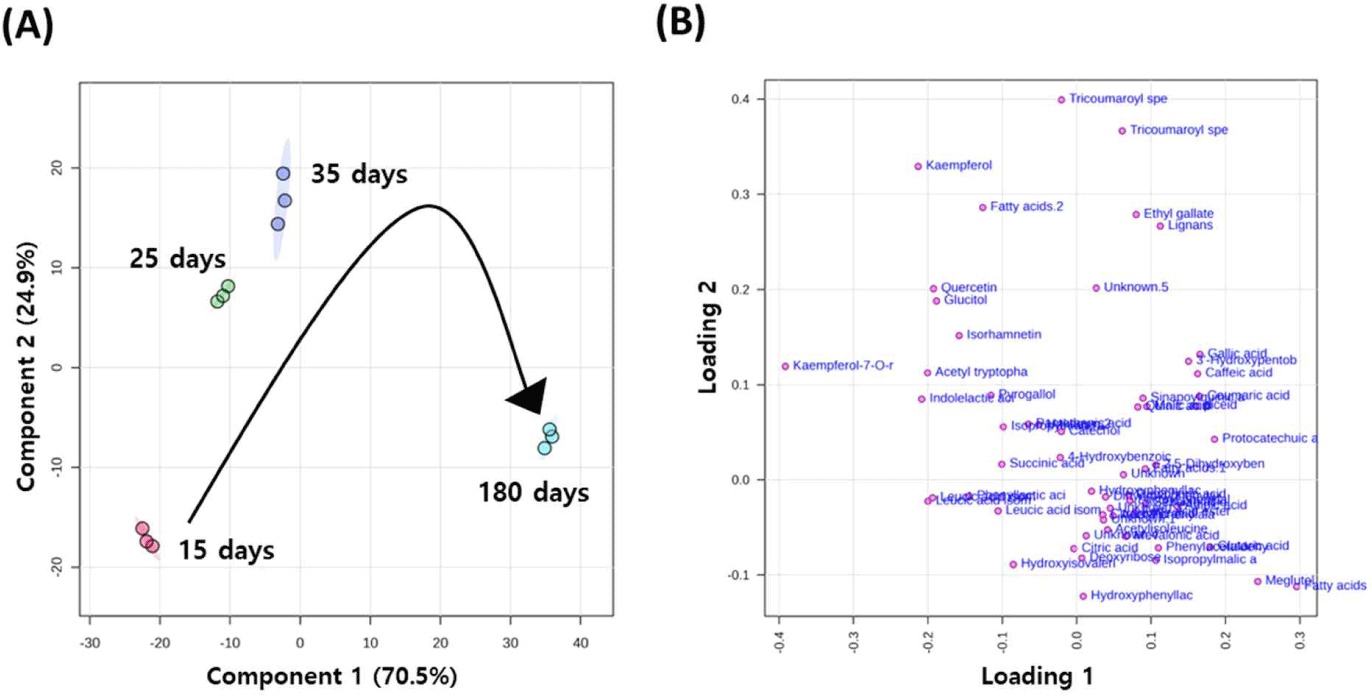
뜰보리수 열매 식초를 제조하는 동안 대사체 변화를 이해하고자, LC-MS 대사체 분석 결과를 기반으로 다변량 통계분석을 실시하였다. PLS-DA score plot에서는 발효기간에 따라 뜰보리수 열매의 식초 발효액들이 확연하게 구별되었다. Loading plot에서는 발효 180일째의 식초에 다양한 대사체들이 존재하고 있음을 알 수 있었다(Fig. 3). 발효 기간에 따른 뜰보리수 열매 식초에서 동정된 59종 화합물들의 상대적 함량 변화를 알아보고자 heatmap 분석을 실시하였다(Fig. 4). 그 결과, 뜰보리수 열매 식초 제조에 있어서 발효가 진행됨에 따라 gallic acid, caffeic acid, coumaric acid 등과 같은 phenolic acid류가, 유기산인 meglutol, glutaric acid 등이 증가됨을 나타냈다. 이와 달리 발효가 진행됨에 따라 quercetin, kaempferol, isorhamnetin 등과 같은 flavonoid류가, leucic acid, indolelactic acid, phenyllactic acid 등과 같은 아미노산 및 그 유도체가 감소하는 경향이었다.
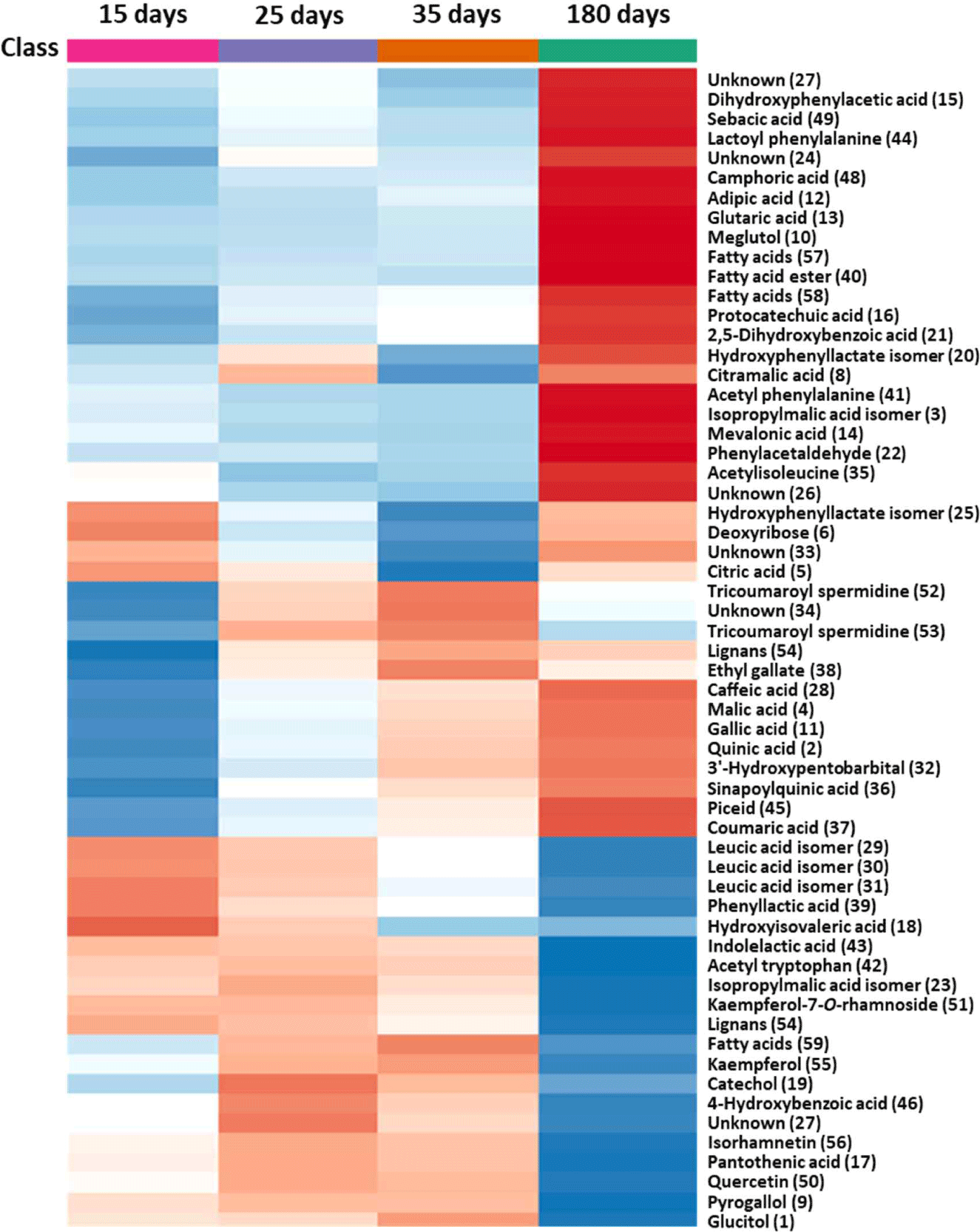
Flavonoid류와 아미노산 및 그 유도체들은 뜰보리수 열매 식초를 제조하는 동안 다소 감소하였으며, 발효 35일부터 발효 180일에서 그 감소가 현저하였다. 이는 뜰보리수 열매를 제조하는 동안 kaempferol 및 quercetin 등의 다수의 flavonoid 배당체들이 가수분해되거나 분해되어 그 함량이 감소한 것으로 시사된다[26]. Leucic acid 및 phenyllactic acid 등을 포함한 아미노산 및 그 유도체들은 발효가 진행되면서 초산균이 에너지원으로 이용되어 감소된다고 보고[27]된 바 있어 뜰보리 수 열매 식초 또한 발효과정 중 감소한 것으로 여겨진다. Gallic acid, caffeic acid, coumaric acid 등과 같은 phenolic acid류는 알코올 및 초산 발효가 진행됨에 따라 그 배당체 화합물 또는 tricoumaroyl spermidine 등과 같은 대사체들이 가수분해되어 증가한 것으로 판단된다. 그리고, meglutol과 glutaric acid 등과 같은 유기산류는 초산 발효 과정 중에 미생물의 대사에 의해 생성되어 증가하는 것으로 여겨진다.
요 약
본 연구에서는 뜰보리수 열매 식초를 자연 발효하는 동안 발효 기간에 따른 발효 특성 및 비휘발성 대사체 변화를 이해하고자 하였다. 뜰보리수 열매 식초는 발효가 진행하면서 pH는 감소하고 총산도는 증가하였다. 색도의 경우 발효가 진행됨에 따라 황색도는 높아졌으나 적색도는 발효가 진행되는 동안 거의 변화가 일어나지 않았다. 뜰보리수 열매 식초의 총 페놀성 화합물 및 총 flavanoid 함량은 발효가 진행되면서 유의적으로 증가하였으며, ABTS+ radical scavenging 활성 및 철 환원력은 발효 35일째까지 증가하였다가 발효 180일째에 감소하였다. UPLC-ESI-QTOF-MS를 이용하여 뜰보리수 열매 식초를 제조하는 동안 비표적 비휘발성 대사체 분석을 실시한 결과, 뜰보리수 열매 식초에는 유기산, 아미노산 및 그 유도체, phenolic acid류, flavonoid류 그리고 tricoumaroyl spermidine류 등이 주요 대사체로 동정되었다. PLS-DA score plot에서 뜰보리수 열매 식초는 발효 기간에 따라 뚜렷하게 구별되었다. 뜰보리수 열매 식초는 발효가 진행되면서 flavonoid류와 아미노산 및 그 유도체들은 감소하는 반면, phenolic acid류와 유기산류는 증가하는 경향을 나타냈다. 뜰보리수 열매에는 tricoumaroyl spermidine류와 flavonol glycoside류가 주요 유용성분임을 알 수 있었다. 이러한 결과들은 뜰보리수 열매를 기반으로 한 가공식품의 품질관리를 위한 기초 자료로 활용이 기대된다.






